导语
脑损伤治疗一直是再生医学领域的重大挑战。近日,中国科学院广州生物医药与健康研究院巫林平、潘光锦团队在国际权威期刊《Advanced Research》发表突破性成果,成功开发出一种新型”鸡尾酒”水凝胶,通过模拟脑组织微环境,显著提升人源神经前体细胞的移植存活率与功能整合能力,为脑皮层损伤修复提供了全新策略。该研究获国家自然科学基金等支持,标志着我国在神经再生材料领域取得重要进展。
一、脑损伤治疗困境:细胞移植面临三大难题
人源神经前体细胞(hNPCs)因具备分化为神经元和胶质细胞的潜能,被视为脑损伤修复的理想”种子细胞”。然而,临床转化中存在三大瓶颈:
- 移植存活率低:移植细胞易因缺血、炎症等微环境压力死亡;
- 分化方向失控:细胞可能异常分化为非功能型细胞;
- 整合能力差:新生神经元难以与宿主神经网络有效连接。
“传统水凝胶材料仅提供物理支撑,无法模拟脑组织的复杂生化信号。”团队负责人巫林平研究员指出,”这导致移植细胞难以存活并发挥功能。”
二、创新解决方案:”鸡尾酒”水凝胶的多重仿生设计
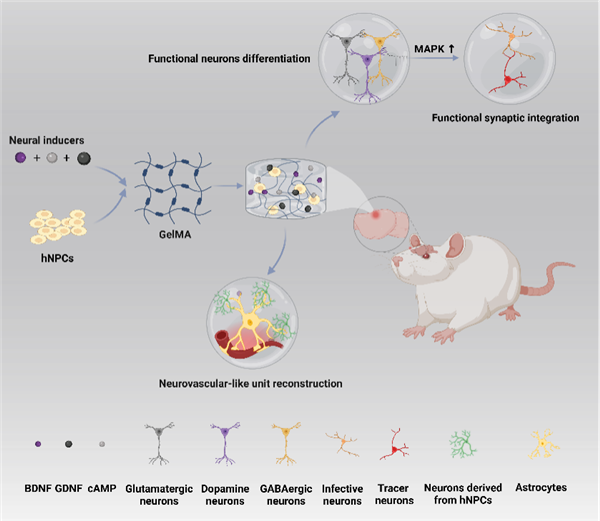
研究团队从”材料结构”与”微环境模拟”双路径切入,开发出一种复合型水凝胶(图1),其核心创新点包括:
1. 三维仿生支架:精准调控孔径与力学性能
- 通过优化水凝胶组分(如明胶甲基丙烯酰基、透明质酸等)与交联条件,制备出孔径梯度分布的三维支架;
- 支架弹性模量(~1 kPa)接近脑组织,可促进细胞黏附、铺展及营养交换。
2. 动态活性微环境:持续释放诱导因子
- 水凝胶负载神经营养因子(如BDNF、NGF)及小分子抑制剂(如ROCK抑制剂),形成”鸡尾酒”式组合;
- 通过控释技术实现因子的梯度释放,模拟脑发育过程中的信号调控。
3. 血管-神经协同再生:招募内皮细胞形成血管网络
- 凝胶中的VEGF模拟肽可募集宿主内皮细胞,在损伤区构建新生血管;
- 血管网络为移植细胞提供氧气与营养,同时促进神经突触延伸。
三、实验验证:从细胞行为到动物功能恢复
研究团队通过多维度实验验证了该水凝胶的效能:
1. 细胞层面:定向分化与突触形成
- 在体外实验中,hNPCs在水凝胶支架上培养7天后,谷氨酸能神经元分化比例提升至65%(传统支架仅30%);
- 电生理检测显示,新生神经元具备稳定的动作电位发放能力,突触密度提高2.3倍。
2. 动物实验:功能修复与运动协调改善
- 在大鼠脑皮层损伤模型中,移植水凝胶-hNPCs复合物后:
- 移植细胞存活率提升至82%(对照组仅45%);
- 损伤区新生血管密度增加50%,神经纤维再生长度延长至3 mm;
- 术后8周,大鼠运动协调性测试得分提高60%,接近正常水平。
四、机制解析:仿生结构与信号通路的协同作用
通过单细胞测序与分子生物学分析,团队揭示了水凝胶发挥作用的三大机制:
- 力学信号传导:支架的弹性模量激活细胞YAP/TAZ通路,促进存活与分化;
- 化学信号调控:持续释放的BDNF通过TrkB受体增强神经元极性建立;
- 免疫微环境重塑:凝胶抑制小胶质细胞过度活化,减少炎症因子(如IL-1β)释放。
“这种多靶点协同策略解决了单一材料或因子的局限性。”潘光锦研究员强调。
五、临床转化前景与未来方向
该成果已申请国家发明专利3项,下一步将开展灵长类动物实验。研究团队提出未来优化方向:
- 个性化定制:结合患者MRI数据打印适配的水凝胶结构;
- 多功能集成:负载抗瘢痕药物或光遗传学元件;
- 产业化开发:与医疗器械企业合作推进临床转化。
“我们的目标是开发一种’即用型’脑修复材料,未来可能通过微创手术注射到损伤部位。”巫林平展望道。
结语
此项研究不仅为脑损伤治疗提供了创新解决方案,更开辟了”材料-细胞-微环境”协同调控的新范式。随着再生医学与材料科学的交叉融合,人类攻克神经系统疾病的梦想正逐步照进现实。